Insekten, Nagetiere und Schädlinge ausmerzen
Da Insektengenetiker am meisten zur Entwicklung der Gene-Drive-Technologie beigetragen haben, sind die Versuche Gene Drives zur Ausrottung von Insekten einzusetzen am weitesten fortgeschritten. Die Forscher wollen an erster Stelle die häufigsten Schädlinge wie Fruchtfliegen, Heuschrecken und pflanzensaugende Käferarten mit Gene Drives ausstatten, um damit wildlebende Populationen zu bekämpfen. Dadurch erhoffen sie sich die Kosten für Pestizide und verlorene Ernten zu ersparen. In einigen Fällen, wie bei einem Projekt zur Bekämpfung der Kirschessigfliege (Drosophila suzukii), haben bereits die ersten Freisetzungen in Agrar-Ökosystemen stattgefunden.
Dieses aus Asien stammende Insekt hat sich in den letzten Jahren sowohl in Nordamerika als auch in Europa zu einem gefürchteten Schädling entwickelt, der massive Ernteausfälle verursacht. Weil er vor allem reife Früchte und Beeren befällt, kann er nur begrenzt mit Insektiziden in Schach gehalten werden. Nützlinge, die die Larven der Kirschessigfliege parasitieren, wurden bislang keine gefunden und das Einnetzen – die einzige wirksame Methode gegen die Schäden, die sie verursacht – ist teuer. Deshalb wollen Wissenschaftler die Fliege mit Hilfe von Gene Drives dezimieren. Dazu nutzen sie einen Mechanismus, den sie mit Anspielung auf die Zauberin aus der griechischen Mythologie, die ihre Nachkommen tötete, Medea genannt haben. Das Akronym steht für „Maternal Effect Dominant Embryonic Arrest“ und bezeichnet einen Vererbungsmechanismus, der auf dem Gift-Gegengift-Prinzip beruht. Dabei werden weibliche Kirschessigfliegen im Labor mit einem neuen Genabschnitt versehen. Dieser sorgt dafür, dass das Weibchen während des Eisprungs ein Toxin produziert, das der Entwicklung der Embryonen ein Ende setzt – ausser wenn diese selbst Träger des Medea-Gens sind. In diesem Fall produziert der Embryo ein Gegengift, das ihm zum Überleben verhilft. Das System ermöglicht, dass eine gewünschte Eigenschaft zu 100 Prozent an die Nachkommen weitergegeben wird und sich rasch in den Populationen verbreitet. Indem sie ein entsprechendes Gen an das Medea-Gen koppeln, können Forscher die Kirschessigfliege verwundbar gegen bestimmte Umweltfaktoren, zum Beispiel gegen höhere Temperaturen machen. Das Prinzip ist einfach: wird es zu heiss, sterben die Nachkommen.
Das Medea-System erwies sich in Laborversuchen zwar als funktionsfähig. Fraglich ist aber ob und wie es seine Wirkung in natürlichen Ökosystemen entfaltet, denn seine Effizienz ist stark von der Populationsdynamik abhängig. Für einen optimalen Effekt müsste eine sehr grosse Anzahl an veränderten Individuen freigelassen werden. Befürworter der Technologie sehen darin einen Vorteil, da dies verhindern soll, dass versehentlich einzelne freigesetzte Individuen eine unaufhaltbare Kettenreaktion auslösen und so zu einer unkontrollierten Ausrottung natürlicher Populationen führen.
Ein weiteres ungelöstes Problem stellen Resistenzbildungen gegen den Gene-Drive-Mechanismus dar. Zudem könnte der Mechanismus an andere Arten weitergegeben werden, da Artengrenzen oft keine klare Barriere für die Kreuzung verschiedener Arten darstellen. Die Folgen könnten schwerwiegend sein. Letztendlich ist das vorhandene Wissen über die Rolle eines Schädlings im Ökosystem mangelhaft, was die Einschätzung der möglichen Effekte einer Ausrottung der Art verhindert. Im Falle aus fremden Gebieten eingeschleppter Organismen, bedroht deren Aussterben das Ökosystem jedoch nicht. Viel mehr besteht das Risiko, dass ihre veränderte Genetik sich durch Paarung auf verwandte Arten überträgt.
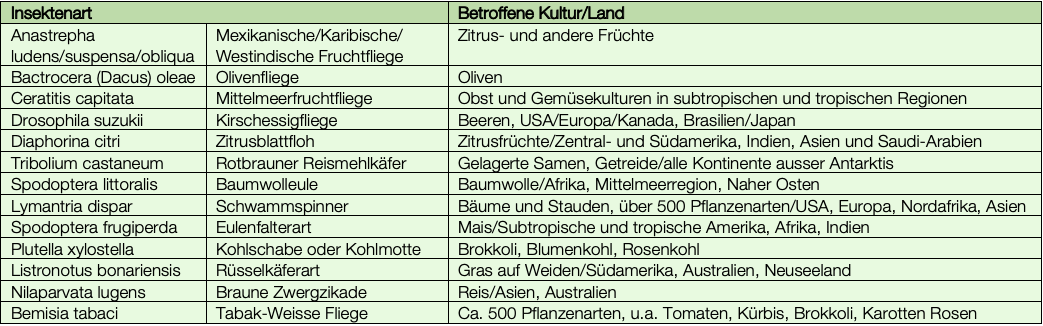
Die Kirschessigfliege ist nur eine der vielen Insektenschädlinge, die die Forscher mit einem Gene-Drive-Konstrukt bekämpfen möchten. Einen Überblick über einige mögliche Kandidaten bietet die folgende Tabelle:
Forscher und Investoren sind auch daran interessiert, Populationen von Säugetieren, die die Lagerung von Agrarprodukten gefährden, zu dezimieren. Nagetiere, wie Mäuse und Ratten verursachen jedes Jahr landwirtschaftliche Schäden in Billionenhöhe. Für die Agrarindustrie Grund genug, um in die Entwicklung von neuen Schädlingsbekämpfungsmassnahmen zu investieren. Mehrere Laboratorien arbeiten bereits daran, Mäusepopulationen mit einem «Selbstvernichtungsgen» auszustatten. Da Mäuse der meistbenützte Modellorganismus unter den Säugetieren darstellen, sind schon umfangreiche Kenntnisse über ihren Genom sowie auch über geeignete molekulare Werkzeuge für diese Manipulation vorhanden. Ein Lösungsansatz soll der sogenannte X-shredder sein. Wie der Name verrät, handelt es sich dabei um einen Gene-Drive-Mechanismus, der die für die Bestimmung des weiblichen Geschlechts verantwortlichen X-Chromosomen zerstört. Somit wachsen gar keine weiblichen Nachkommen mehr heran. Andere Forschungsteams wollen dieses Ziel anders erreichen: sie planen ein Gene Drive mit dem Sry Gen, das für die Entwicklung männlicher Eigenschaften verantwortlich ist. Im Labor zeichnen sich einige Erfolge ab. Jedoch gibt es zahlreiche technische Barrieren, woran ein Einsatz in der freien Natur scheitern könnte. Denn es ist wesentlich schwieriger Gene Drives in Säugetieren als in Insekten herzustellen. Auch die Risiken sind hoch: GD-Mäuse könnten leicht versehentlich auf andere Regionen oder Kontinente transportiert werden und somit andere Populationen als die eigentliche Zielpopulation unaufhaltbar dezimieren. Zudem könnten sie sich mit anderen Mausarten kreuzen und so das Gene-Drive-Konstrukt weitergeben. Da die Rolle der Maus im Ökosystem nicht völlig geklärt ist, weiss niemand, welche negativen ökologischen Folgen eine drastische Reduktion der Anzahl Mäuse haben würde.
Auch wenn nur selten, wird überlegt, Gene Drives bei Vögeln anzuwenden. In Australien sind Stare (Sturnus vulgaris) unerwünscht. Die Vögel wurden gegen Ende des 19. Jahrhunderts eingeführt, um Insektenschädlinge zu bekämpfen. Anfang des 20. Jahrhunderts hat sich die Art aber so stark verbreitet, dass sie den Landwirten selber zur Last fielen. Aktuell verursachen sie jährlich mehrere hundert Millionen Dollar Schäden. Australische Biotechnologen sehen also in Gene Drives ein potenzielles Werkzeug, um die Art auszumerzen.
Wie ein Patentantrag der University of California zeigt, könnten auch über 60 Fadenwurmarten, die die Wurzeln verschiedenster Nutzpflanzen befallen, mit Gene Drives ausgestattet und somit bekämpft werden.
Nicht nur Tiere sind im Visier der Gene-Drive-Entwickler: Manche Forscher behaupten, Gene Drives hätten das Potenzial pathogene Pilze, wie den Hefepilz Candida albicans, der bei Nutztieren häufig Probleme verursacht, zu stoppen.
